Ion là gì?
[block id=”breadcrumb”]
[block id=”google-news-2″]
Ion là một khái niệm cơ bản trong hóa học, liên quan đến các nguyên tử hoặc nhóm nguyên tử mang điện tích. Việc hiểu rõ ion, quá trình ion hóa và vai trò của chúng trong các phản ứng hóa học là rất quan trọng. Hãy cùng tìm hiểu chi tiết về ion và các ứng dụng của nó trong bài viết này.
1. Ion là gì? Khái niệm cơ bản về ion và điện tích
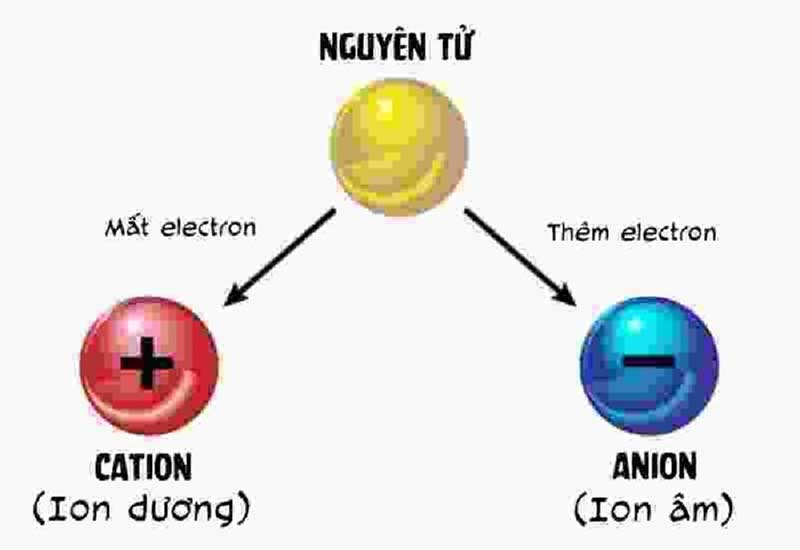
Ion là một nguyên tử hoặc nhóm nguyên tử có điện tích. Khi một nguyên tử mất đi hoặc thu được một hoặc nhiều electron, nó sẽ trở thành ion. Nếu nguyên tử mất electron, nó sẽ mang điện tích dương và được gọi là cation. Ngược lại, nếu nguyên tử thu electron, nó sẽ mang điện tích âm và được gọi là anion. Việc này xảy ra qua một quá trình gọi là ion hóa.
2. Phân loại ion: Anion và Cation
Các ion được phân chia thành hai loại chính: cation và anion. Cation là các ion mang điện tích dương, thường được hình thành khi các kim loại như natri (Na+) hoặc magie (Mg2+) mất electron. Anion là các ion mang điện tích âm, ví dụ như clorua (Cl−) hoặc sulfat (SO42−), được hình thành khi các phi kim loại nhận electron.

3. Quá trình ion hóa: Cách thức và yếu tố ảnh hưởng
Ion hóa là quá trình mà trong đó một nguyên tử hoặc phân tử mất hoặc nhận electron. Quá trình này phụ thuộc vào năng lượng ion hóa, tức là năng lượng cần thiết để loại bỏ electron khỏi nguyên tử. Năng lượng ion hóa có thể thay đổi tùy thuộc vào yếu tố như cấu trúc lớp obitan và điện tích của nguyên tử. Những yếu tố này ảnh hưởng đến khả năng của nguyên tử tạo ra ion dương hoặc ion âm.
4. Các nguyên tử và ion phổ biến: Na+, Cl−, SO42−, Mg2+, Al3+
Trong hóa học, một số ion phổ biến bao gồm Na+ (cation natri), Cl− (anion clorua), SO42− (anion sulfat), Mg2+ (cation magie), và Al3+ (cation nhôm). Những ion này đóng vai trò quan trọng trong nhiều phản ứng hóa học và có mặt trong nhiều hợp chất trong tự nhiên và công nghiệp.
5. Năng lượng ion hóa: Định nghĩa và tác động đối với ion
Năng lượng ion hóa là năng lượng cần thiết để loại bỏ một electron khỏi nguyên tử hoặc ion. Các ion có năng lượng ion hóa cao thường khó bị ion hóa. Ví dụ, natri (Na+) có năng lượng ion hóa thấp, dễ dàng mất electron để trở thành cation. Các yếu tố như cấu trúc lớp obitan và số lượng electron sẽ quyết định mức năng lượng này.
6. Vai trò của ion trong hóa học và các ứng dụng thực tế
Ion đóng vai trò cực kỳ quan trọng trong hóa học. Chúng tham gia vào các phản ứng hóa học, bao gồm phản ứng trao đổi ion trong dung dịch, và trong các phản ứng điện hóa học. Ions cũng có ứng dụng trong các lĩnh vực như sản xuất điện, công nghệ pin, và nhiều quá trình sinh học trong cơ thể người.
7. Lịch sử nghiên cứu về ion: Từ Michael Faraday đến Svante August Arrhenius
Michael Faraday là người đầu tiên đưa ra khái niệm về ion vào khoảng năm 1830. Tuy nhiên, lý thuyết ion được phát triển đầy đủ bởi Svante August Arrhenius vào cuối thế kỷ 19. Những công trình của ông đã giúp chúng ta hiểu rõ hơn về quá trình ion hóa và vai trò của các ion trong phản ứng hóa học, đóng góp quan trọng vào việc phát triển lý thuyết hóa học hiện đại.
8. Tên gọi ion: Ý nghĩa và nguồn gốc từ ngữ học
Từ “ion” có nguồn gốc từ tiếng Hy Lạp “ἰόν,” có nghĩa là “người đi lại,” ám chỉ sự di chuyển của các ion trong các trường điện. Michael Faraday đặt tên này do sự di chuyển của các ion về phía các điện cực trong dung dịch điện phân.
9. Sự khác biệt giữa kim loại và phi kim loại trong việc tạo ra ion
Kim loại thường dễ dàng tạo ra cation, ví dụ như natri (Na+) và magie (Mg2+), bởi vì chúng có ít electron ở lớp ngoài cùng và dễ dàng mất electron. Ngược lại, phi kim loại như clo (Cl−) và oxi (O2−) thường nhận electron để trở thành anion, do cấu trúc electron của chúng dễ dàng thu hút electron từ các nguyên tử khác.
10. Các khái niệm liên quan: Electron, lớp obitan và chuyển động của ion
Electron là các hạt mang điện tích âm, di chuyển xung quanh hạt nhân của nguyên tử trong các lớp obitan. Chuyển động của ion liên quan mật thiết đến sự di chuyển của các electron khi chúng bị mất hoặc nhận. Cấu trúc lớp obitan của nguyên tử cũng ảnh hưởng đến khả năng ion hóa của nguyên tử, quyết định việc chúng có dễ dàng trở thành cation hay anion hay không.
Các chủ đề liên quan: Ion , Electron , Anion , Cation , Ion hóa , Năng lượng ion hóa , Cation benzil , Obitan , Arrhenius , Michael Faraday
[block id=”quang-cao-2″]
[block id=”tac-gia-4″]